J Nanobiotechnology:超声响应纳米载体siRNA和Fe3O4增强非小细胞肺癌免疫治疗
来源:生物谷原创 2024-10-31 10:12
研究结果表明:该传递系统能有效地将m2样巨噬细胞转化为M1,增强其吞噬能力,促进抗原提呈,进而诱导t细胞活化,同时抑制免疫抑制细胞在NSCLC中的浸润,对抑制细胞的侵袭和迁移起着至关重要的作用。
非小细胞肺癌(NSCLC)是肺癌的主要形式,约60%的患者被诊断为晚期。近年来,免疫疗法在治疗晚期肺癌方面显示出良好的效果。然而,只有约20%的癌症患者对免疫治疗有持久的反应,这可能归因于不同的免疫检查点变化、肿瘤微环境(TME)复杂性和其他相关因素,这严重阻碍了免疫疗法的广泛应用。因此,迫切需要发现更有效的免疫治疗靶点,而非小细胞肺癌免疫治疗的潜在突破可能取决于探索联合治疗。
研究发现, Fe3O4纳米颗粒可诱导巨噬细胞从m2样细胞向m1样细胞转变,使其成为癌症免疫治疗的潜在纳米平台。tam中高浓度的铁可能通过激活干扰素调节因子5(IRF5)通路刺激炎症反应而参与这种重编程。然而,单独使用氧化铁纳米颗粒诱导的免疫反应是有限的,不能显著抑制肿瘤生长。
纳米颗粒(NPs)已成为很有前景的基因传递载体,它可以包装和保护基因免受酶降解,促进基因转运到细胞质或避免溶酶体包裹,并将基因货物释放到细胞翻译装置中。近年来,叶酸(FA)已被证明对人体具有重要的生物学功能,也可以作为靶向剂,特别是在癌症应用中。叶酸受体(FR)是一种对FA具有高亲和力的细胞表面糖蛋白,可促进FA的主动摄取。FRβ在m2样巨噬细胞中显著上调,使FA成为靶向治疗tam的有效调节剂。这种增强促进了纳米颗粒在肿瘤中的积累,同时最小化了全身毒性。
超声触发的纳米颗粒药物释放提供了一种很有前途的策略,可以防止药物在非靶向组织中过早释放,并在超声(US)暴露时增强药物对肿瘤细胞的渗透。低强度聚焦超声(LIFU)的力学和热效应可以诱导全氟戊烷(PFP)等液气材料的相变,导致声液滴汽化(ADV)和气体微/纳米气泡的产生,从而增强超声成像能力。
在LIFU刺激下,PFP转变为气态,形成微/纳米气泡,放大超声成像。PFP在持续激发下的连续液气转换、超声穿孔效应和超声诱导空化可以促进靶向药物/基因传递,实现个性化治疗方法。因此,在纳米气泡中掺入Fe3O4纳米颗粒和SIRPα siRNA可以减轻药物的泄漏和降解,从而提高治疗效果。

图片来源:https://doi.org/10.1186/s12951-024-02883-w
近日,来自兰州大学第二医院的研究者们在J Nanobiotechnology杂志上发表了题为“Ultrasound-responsive nanocarriers with siRNA and Fe3O4 regulate macrophage polarization and phagocytosis for augmented non-small cell lung cancer immunotherapy”的文章,该研究强调了超声纳米技术支持SIRPα siRNA和Fe3O4递送的潜力,是作为巨噬细胞免疫治疗重塑癌症治疗免疫抑制肿瘤微环境的有效策略。
免疫抑制性肿瘤微环境显著抑制有效的抗肿瘤免疫应答,极大地影响免疫治疗的疗效。大多数肿瘤相关巨噬细胞(tam)属于M2表型,这在非小细胞肺癌(NSCLC) TME的免疫抑制作用中起重要作用。巨噬细胞上表达的信号调节蛋白α (SIRPα)与癌细胞上过表达的跨膜蛋白CD47相互作用,激活“eat-me-not”信号通路,抑制吞噬作用。
在本研究中,研究者采用1,2-二酰基-3-三甲基丙烷(DOTAP)、FA-1,2-二脂酰- san -甘油-3-磷酸乙醇胺- n-[氨基(聚乙二醇)2000](DSPEPEG2000-FA)、胆固醇和全氟戊烷(PFP),构建了叶酸(FA)修饰的超声响应基因/药物递送系统,命名为FA@ PFP @ Fe3O4 @ lnb -SIRPα siRNA (FA- pfnb -SIRPα siRNA),用于递送编码SIRPα mRNA和免疫佐剂Fe3O4纳米颗粒的siRNA。
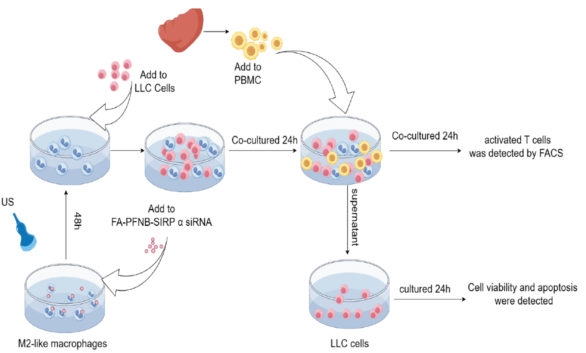
细胞实验示意图
图片来源:https://doi.org/10.1186/s12951-024-02883-w
研究结果表明:该传递系统能有效地将m2样巨噬细胞转化为M1,增强其吞噬能力,促进抗原提呈,进而诱导t细胞活化,同时抑制免疫抑制细胞在NSCLC中的浸润,对抑制细胞的侵袭和迁移起着至关重要的作用。超声条件下,纳米气泡有效转染巨噬细胞,抑制SIRPα mRNA和蛋白表达,促进tam的吞噬,协同逆转M2极化。结合靶向NB系统,US在小鼠中是安全且耐受性良好的,并且没有全身毒性,使其成为可靠的基因传递系统。该系统促进T细胞的浸润,增强细胞毒性T细胞的增殖和活化,抑制肿瘤组织中免疫抑制细胞的浸润。FA-PFNB-SIRPα siRNA联合超声治疗可显著抑制NSCLC进展。
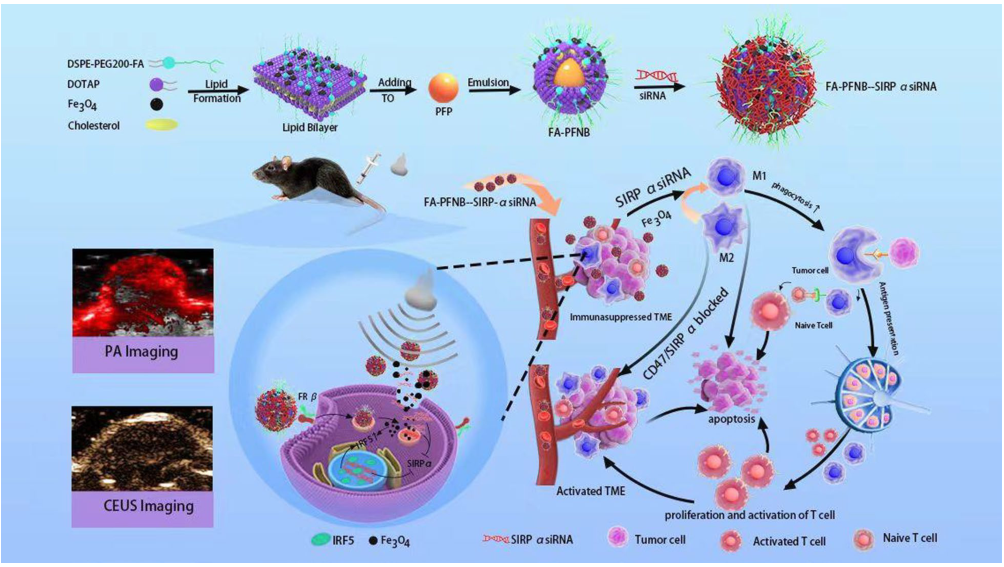
超声响应纳米载体siRNA和Fe3O4增强非小细胞肺癌免疫治疗
图片来源:https://doi.org/10.1186/s12951-024-02883-w
综上所述,本研究的新型叶酸修饰的NBs在递送Fe3O4纳米颗粒和SIRPα siRNA方面表现出高效率和安全性,随着其未来应用的潜力,这种针对非小细胞肺癌和潜在的其他肿瘤类型的策略提供了一种基于免疫细胞募集和激活的癌症免疫治疗的新方法,将其与当前的免疫疗法区分开来。(生物谷 Bioon.com)
参考文献
Ming Li et al. Ultrasound-responsive nanocarriers with siRNA and Fe3O4 regulate macrophage polarization and phagocytosis for augmented non-small cell lung cancer immunotherapy. J Nanobiotechnology. 2024 Oct 7;22(1):605. doi: 10.1186/s12951-024-02883-w.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


